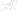Pathophysiologie der Alzheimer Demenz
Demenzerkrankungen sind definiert durch den Abbau und Verlust kognitiver Funktionen und Alltagskompetenzen. Bei der Alzheimer Demenz handelt es sich um eine progredient verlaufende Erkrankung. Im Verlauf der Erkrankung kommt es zur Beeinträchtigung der Orientierung, der Kommunikationsfähigkeit, der autobiographischen Identität und der Veränderung von Persönlichkeitsmerkmalen. Die Demenz vom Alzheimer Typ zeichnet sich durch charakteristische neuropathologische und neurochemische Veränderungen aus. Sie beginnt meist schleichend und entwickelt sich dann langsam, aber stetig über einen Zeitraum von mehreren Jahren.
"Wie heißen Sie?“ – "Auguste.“
"Familienname?“ – "Auguste.“
"Wie heißt ihr Mann?“ – "Ich glaube Auguste.“
 Das Gespräch zwischen dem Psychiater Alois Alzheimer und seiner Patientin Auguste Deter schrieb Medizingeschichte. Mit ihm begann im November 1901 die Erforschung der Alzheimer Erkrankung, an der allein in Deutschland 1,4 Mio. Menschen und weltweit 20 Mio. Menschen erkrankt sind. Am 08.04.1906 starb Auguste Deter in der "Anstalt für Irre und Epileptische“ in Frankfurt am Main "total verblödet“, wie Alois Alzheimer notierte.
Das Gespräch zwischen dem Psychiater Alois Alzheimer und seiner Patientin Auguste Deter schrieb Medizingeschichte. Mit ihm begann im November 1901 die Erforschung der Alzheimer Erkrankung, an der allein in Deutschland 1,4 Mio. Menschen und weltweit 20 Mio. Menschen erkrankt sind. Am 08.04.1906 starb Auguste Deter in der "Anstalt für Irre und Epileptische“ in Frankfurt am Main "total verblödet“, wie Alois Alzheimer notierte.
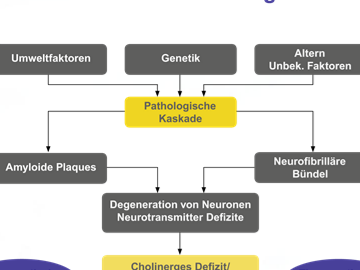
Nach heutigem Wissen gibt es unterschiedliche Ursachen und Risikofaktoren für die Entstehung der Alzheimer-Demenz. Man unterscheidet neben der sporadischen die familiäre Alzheimer-Demenz, welche sich häufig deutlich früher manifestiert. Zu den vermuteten Risikofaktoren gehören Alter, Geschlecht, was fraglich ist, genetische Disposition, Schädel-Hirn-Trauma, Schulbildung, Alkohol und Ernährung.
Hinsichtlich der Ernährung gibt es Anhaltspunkte dafür, dass durch fett- u. kalorienreiche Ernährung das Risiko zu erkranken steigt.
Dementsprechend scheint durch vermehrten Fischverzehr und mehrfach ungesättigte Fettsäuren das Erkrankungsrisiko zu sinken. Weiter erhöhen kardiovaskuläre Erkrankungen (ApoE-Polymorphismus, Diabetes, Hypertonie, Hypercholesterinämie) das Risiko, an einer Alzheimer-Demenz zu erkranken.
Das persönliche Risiko eines Angehörigen ersten Grades, selbst irgendwann zu erkranken, ist statistisch höher als das einer Vergleichsperson ohne "familiäre Belastung“. Es konnte nachgewiesen werden, dass neben der Anzahl erkrankter Verwandter auch das Alter der Erstmanifestation bezüglich des Risikos von relevanter Bedeutung ist.
 Im Rahmen der Alzheimer Demenz kommt es zu einer Hirnvolumenabnahme mit charakteristischem Befallsmuster. Es zeigt sich eine Atrophie der Temporal- und Frontallappen. Mit einbezogen ist die Hippocampusregion, die eine wichtige Funktion für Gedächtnis und Lernprozesse darstellt. Während der Hippocampus früh betroffen ist, sind kortikale Areale in der Regel erst im weiteren Krankheitsverlauf mit einbezogen, insbesondere der temporale Kortex aber auch der frontale Kortex können involviert sein. Mit wenigen Ausnahmen sind primär motorischer Kortex und visueller Kortex nur in sehr späten Krankheitsstadien oder gar nicht betroffen.
Im Rahmen der Alzheimer Demenz kommt es zu einer Hirnvolumenabnahme mit charakteristischem Befallsmuster. Es zeigt sich eine Atrophie der Temporal- und Frontallappen. Mit einbezogen ist die Hippocampusregion, die eine wichtige Funktion für Gedächtnis und Lernprozesse darstellt. Während der Hippocampus früh betroffen ist, sind kortikale Areale in der Regel erst im weiteren Krankheitsverlauf mit einbezogen, insbesondere der temporale Kortex aber auch der frontale Kortex können involviert sein. Mit wenigen Ausnahmen sind primär motorischer Kortex und visueller Kortex nur in sehr späten Krankheitsstadien oder gar nicht betroffen.
Die AD, eine progrediente neurodegenerative Erkrankung, ist gekennzeichnet durch den selektiven Verlust von Neuronen, anfänglich aus Hirnarealen, die für das Gedächtnis und die Intelligenz zuständig sind. Dieser neuronale Verfall ist verbunden mit einer Anhäufung extrazellulärer seniler Plaques (b-Amyloid) sowie Neurofibrillenbündeln (NFT – neurofibrillary tangles)–fadenartigen Bruchstücken des Tauproteins–innerhalb der Zelle.
 Histologisch unterscheidet man Plaques nach ihrer unterschiedlichen Morphologie. Man unterscheidet zwischen klassischen, gemischten und neuritischen Plaques. Extrazelluläres Amyloid zeichnet sich durch einen zentral gelegenen Amyloidkern, hellen Hof und Kranz von granulären Amyloidablagerungen und dystrophen Neuriten aus. Amyloidablagerungen bestehen aus Aß42 u. Aß40. Hierbei handelt es sich um kleine Fragmente eines Transmenbranproteins ß-Amyloid-Precursor-Protein. Physiologischerweise wird es durch die Alpha-Sekretase gespalten, so dass das n-terminale Ende in den Extrazellulärraum gelangt. Es entsteht kein Aß42. Durch Spaltung erst mittels Beta- , dann Gamma-Sekretase (Präsenilin I, Chr. 14) entsteht Aß40 oder Aß42. Insbesondere Aß42 ist neurotoxisch. Diese polymerisieren, es entstehen neuritische Plaques. Neurofibrillendegeneration, sog. Tangles entsprechen fibrillären Einschlüssen im Zytoplasma von Neuronen. Ultrastrukturell zeigen sich paarige helixartige angeordnete Proteinfilamente, bestehend aus hyperphosphoryliertem Tau-Protein. Hierdurch kommt es letztlich zu einem Zusammenbruch des Zytoskeletts.
Histologisch unterscheidet man Plaques nach ihrer unterschiedlichen Morphologie. Man unterscheidet zwischen klassischen, gemischten und neuritischen Plaques. Extrazelluläres Amyloid zeichnet sich durch einen zentral gelegenen Amyloidkern, hellen Hof und Kranz von granulären Amyloidablagerungen und dystrophen Neuriten aus. Amyloidablagerungen bestehen aus Aß42 u. Aß40. Hierbei handelt es sich um kleine Fragmente eines Transmenbranproteins ß-Amyloid-Precursor-Protein. Physiologischerweise wird es durch die Alpha-Sekretase gespalten, so dass das n-terminale Ende in den Extrazellulärraum gelangt. Es entsteht kein Aß42. Durch Spaltung erst mittels Beta- , dann Gamma-Sekretase (Präsenilin I, Chr. 14) entsteht Aß40 oder Aß42. Insbesondere Aß42 ist neurotoxisch. Diese polymerisieren, es entstehen neuritische Plaques. Neurofibrillendegeneration, sog. Tangles entsprechen fibrillären Einschlüssen im Zytoplasma von Neuronen. Ultrastrukturell zeigen sich paarige helixartige angeordnete Proteinfilamente, bestehend aus hyperphosphoryliertem Tau-Protein. Hierdurch kommt es letztlich zu einem Zusammenbruch des Zytoskeletts.
 APP wird im endoplasmatischen Retikulum gebildet, im Golgi-Apparat glykosiliert und in die Zellmembran integriert. Es gibt 3 Isoformen des APP mit 695, 751 und 770 Aminosäuren. Die physiologische Funktion des APP ist unbekannt.
APP wird im endoplasmatischen Retikulum gebildet, im Golgi-Apparat glykosiliert und in die Zellmembran integriert. Es gibt 3 Isoformen des APP mit 695, 751 und 770 Aminosäuren. Die physiologische Funktion des APP ist unbekannt.
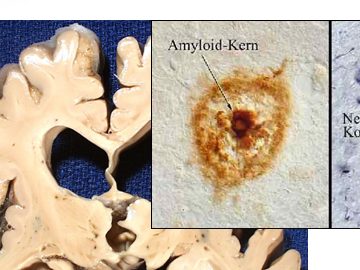
Das Amyloid-Precursor-Protein (APP) unterliegt der Spaltung durch drei unterschiedliche Enzyme. Dabei kann zwischen zwei Wegen bzw. Möglichkeiten der Spaltung unterschieden werden. Diese Folie stellt den physiologischen, nicht-amyloidogene Weg dar. Hier erfolgt die Spaltung durch die Alpha-Sekretase in unmittelbarer Nähe der Membran.
Auf der anderen Seite steht der amyloidogene Weg durch die Beta-Sekretase, die als membranständiges Enzym das APP im Extrazellulärraum schneidet und ein extrazelluläres lösliches Fragment freisetzt. Nachfolgend wird die Transmembranregion des APP durch die Gamma-Sekretase heraus getrennt. Die Abspaltung der intrazellulären Domäne durch die enzymatische Aktivität der Gamma-Sekretase führt schließlich zur Freisetzung des toxischen Beta-Amyloid-Proteins.
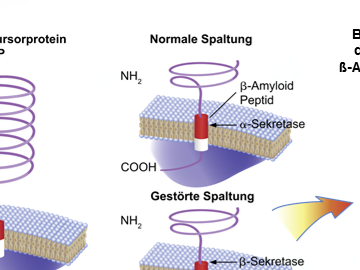 Normalerweise wird das APP innerhalb der b-Sequenz durch die α-Sekretase gespalten. Bei einer fehlerhaften Spaltung am N- und C-terminalen Ende durch b- und γ-Sekretasen entstehen die b-Amyloide Ab-1-40, Ab-1-42 und Ab-1-43.
Normalerweise wird das APP innerhalb der b-Sequenz durch die α-Sekretase gespalten. Bei einer fehlerhaften Spaltung am N- und C-terminalen Ende durch b- und γ-Sekretasen entstehen die b-Amyloide Ab-1-40, Ab-1-42 und Ab-1-43.
Neurofibrillen sind paarige helikale Strukturen. Sie bestehen aus hyperphosphoryliertem Tau-Protein und bilden Neurofibrillenbündel. Das Tau-Protein gehört zu den Mikrotubuli-assoziierten Proteinen (MAPs) und ist für die Aufrechterhaltung der Struktur der Mikrotubuli verantwortlich. Mikrotubuli bilden das Zytoskelett, durch das die zellulären Nährstoffe und andere Moleküle durch die gesamte Zelle transportiert werden. Durch die Hyperphosphorylierung des Tau-Proteins kommt es zur Zerstörung des Zytoskeletts und das zelluläre Transportsystem ist beeinträchtigt.
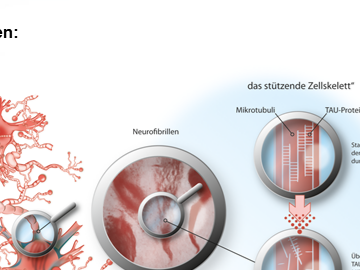 Neurofibrillen werden zumeist im Zellkörper der Nervenzelle gefunden. Es handelt sich hierbei um ein sichtbares Zeichen, dass "das stützende Zellskelett“ in Mitleidenschaft gezogen wird; die Neuronen sterben ab.
Neurofibrillen werden zumeist im Zellkörper der Nervenzelle gefunden. Es handelt sich hierbei um ein sichtbares Zeichen, dass "das stützende Zellskelett“ in Mitleidenschaft gezogen wird; die Neuronen sterben ab.
Neurofibrillen kommen nicht nur bei der Alzheimer-Krankheit vor, sondern treten auch bei anderen neurodegenerativen Erkrankungen auf, z. B. bei Parkinson-ähnlichen Erkrankungen oder der frontotemporalen Demenz.
Die Plaques treten vor dem Erscheinen der Neurofibrillen auf und können die Entstehung dieser möglicherweise einleiten. Die Plaques spielen damit, nach heutigem Kenntnisstand, eine Schlüsselrolle bei der Entstehung der Alzheimer-Demenz. Die genauen Zusammenhänge sind aber nach wie vor ungeklärt.
Bei der AD sind zunächst das cholinerge und glutamaterge Neurotransmittersystem betroffen.
Der Hippocamus und der Cortex sind die wichtigsten Regionen im Gehirn, die an Gedächtnis- und Lernprozessen beteiligt sind. Cholinerge Neurone projizieren vom Nucleus medialis septal zum Hippocampus und vom Nucleus basalis Meynert zum Cortex gemäß Coyle et al. 1983.
 Der Hippocampus ist an der frühen Pathologie der AD beteiligt. In dieser Region treten zahlreiche Plaques und Tangels auf. Man nimmt an, dass diese das Gedächtnis beeinträchtigen. Im progredienten Verlauf der AD sind auch cortikale Regionen, die für komplexe Lern- und Denkprozesse (beispielsweise der Neocortex) benötigt werden, betroffen, insbesondere der temporale Cortex. Auch der frontale Cortex kann involviert sein und zu Verhaltensstörungen beitragen. Im Allgemeinen sind bis zu den fortgeschrittenen, späten Krankheitsstadien die primären motorischen z.B. der parietale Cortex und visuellen Regionen z.B. der occipitale Cortex nicht betroffen.
Der Hippocampus ist an der frühen Pathologie der AD beteiligt. In dieser Region treten zahlreiche Plaques und Tangels auf. Man nimmt an, dass diese das Gedächtnis beeinträchtigen. Im progredienten Verlauf der AD sind auch cortikale Regionen, die für komplexe Lern- und Denkprozesse (beispielsweise der Neocortex) benötigt werden, betroffen, insbesondere der temporale Cortex. Auch der frontale Cortex kann involviert sein und zu Verhaltensstörungen beitragen. Im Allgemeinen sind bis zu den fortgeschrittenen, späten Krankheitsstadien die primären motorischen z.B. der parietale Cortex und visuellen Regionen z.B. der occipitale Cortex nicht betroffen.
Glutamat ist der wichtigste exzitatorische Neurotransmitter im zentralen Nervensystem. Glutamat hat eine zentrale Bedeutung für kognitive Funktionen, insbesondere für das Lernen und Gedächtnis.